
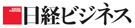
「希少がんというと珍しい病気のように思われるかもしれないが、がんの15〜20%は希少がん。ところが希少がんの薬が日本に入ってこないので、一般的ながんに比べて生存率が低いといわれている」
こう話すのは日本希少がん患者会ネットワークの眞島喜幸理事長だ。がんと診断されてからインターネットで調べて、海外で使われている抗がん剤が日本で使えないことを知って連絡してくる人もいるが、「その薬を日本で使えるようになるまでの間に亡くなってしまうような例もある」という。
同団体は、希少がんの患者会の連携組織として2017年8月に設立され、日本への新薬導入促進などを求める活動をしてきた。眞島氏は「米国で承認された抗がん剤の新薬の半数以下しか日本に入ってきていない実態を、多くの人はがんと診断された後で知るのが現状だ」と警鐘を鳴らす。
欧米承認済みの7割が未承認
平均寿命、健康寿命とも世界トップクラスの日本は、国民の誰もが一定の費用負担で一定レベルの医療を受けられる国として、世界的にも評価されている。だが、最新の医薬品や最新技術を使った治療を受けられるかとなると話は別だ。医薬品だけに着目しても、海外では使えるけれど、国内では使えない品目がざらにある。
こうした薬の存在に対して、昨今「ドラッグロス」という言葉が使われている。数年前から、欧米に比べた日本への新薬の導入遅れを「ドラッグラグ」と称し、国際共同治験への日本の参加を促したり、審査当局の体制を強化して審査期間を短縮したりといった対策が進められてきた。それにより、ドラッグラグは解消に向かったが、今度は日本で新薬開発に着手すらされないドラッグロスが拡大していることが表面化している。
上のグラフは、直近5年間に欧米のいずれかで承認された新薬のうち、日本での未承認薬を調査した結果だ。16〜20年の5年間に承認された243品目のうち、72%に当たる176品目が20年末時点で日本で未承認だ。しかも、未承認品目が年々増加していることが読み取れる。未承認品目のうち、日本で開発中のドラッグラグ品目は81、日本での開発未着手のドラッグロス品目は95だった。
さらに、23年3月時点で、欧米では承認されているけれど国内では開発未着手だった86品目の内訳を示したのが下の図だ。小児用の品目が37%、希少疾病用の品目が47%、新興企業の開発品目が55%を占める(重複を含む)。海外の新興企業が創製した品目や、小児用、希少疾病用の医薬品などが問題になっていることが分かる。「他に治療薬がない」など重要度の高い薬も多い。

ドラッグラグ・ドラッグロス品目の増加に対し、国も手を打ってはいる。政府は23年6月に閣議決定した「経済財政運営と改革の基本方針2023」(骨太方針2023)の中で、「ドラッグラグ・ドラッグロスの問題に対応する」と明記した。
これを受けて厚生労働省は24年度の薬価制度改革で、欧米での初承認から6カ月以内などの要件を満たして日本に早期に導入された品目に対して、「迅速導入加算」と呼ばれる加算を付けた薬価を設定することを決めた。さらに、特にドラッグロスの品目が多い小児用医薬品の開発を促すため、加算率を高くするなどの措置も講じる。
日本の薬価制度では、例えば売上高が想定を上回った品目の薬価を大きく切り下げる「後出しじゃんけん」のようなルールも存在し、製薬企業からは「開発費を投じて日本市場に新薬を導入しても投資の回収が見通せない」といった声が上がっていた。
今回の改革が、ドラッグラグ・ドラッグロスの解消にどのくらい効果を発揮するかは不明だが、改革の内容に対する製薬企業の反応はおおむね良好だ。
ロスを生む薬事規制を見直し
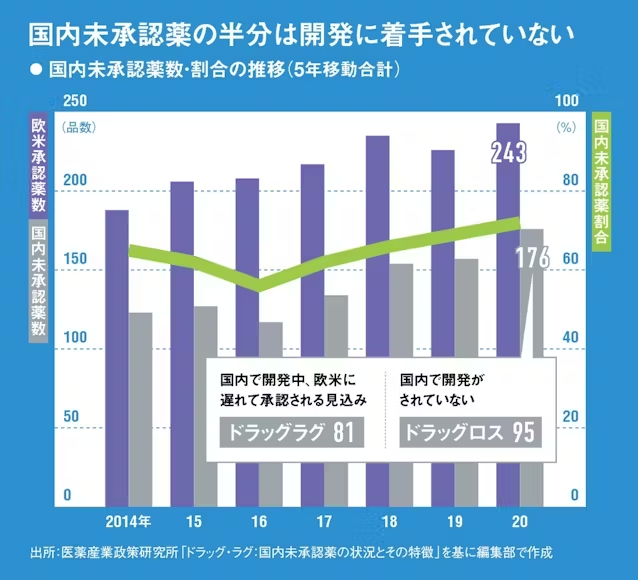
厚労省は23年7月、「創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会」(薬事検討会)を設置し、ドラッグロス問題の解消や、後発医薬品(ジェネリック)の安定供給の確保などを目的に、医薬品に関する規制見直しの議論を開始した。
検討会では下の「薬事検討会における検討事項」に掲げた項目をテーマに、月1回程度のペースで学識経験者らによる議論が続いている。特筆すべきは、23年度内を予定する検討会の取りまとめを待たずに、議論が済んだテーマについては順次、課長名の通知を出すなどして規制見直しの運用を開始していることだ。
例えば23年12月には、検討会での議論に基づいて、厚労省は「海外で臨床開発が先行した医薬品の国際共同治験開始前の日本人での第1相試験の実施に関する基本的考え方について」と題する通知を出した。24年1月には、希少疾病用医薬品の指定や小児用医薬品の開発推進に関する合計4つの通知も出している。
「ああいったスピーディーな対応には感心する」と同検討会の構成員で、新薬メーカーの団体である日本製薬工業協会の薬事委員会委員長である柏谷祐司氏は話す。「検討会で製薬業界の意見を聞く機会を設けてもらえたことには感謝している。業界の意見が全て採用されているわけではないが、提案はかなり受け入れてもらっていると思う」
検討会の議論で製薬企業の関係者が特に注目したのが、前述した「日本人での第1相臨床試験の必要性」に関する議論だ。
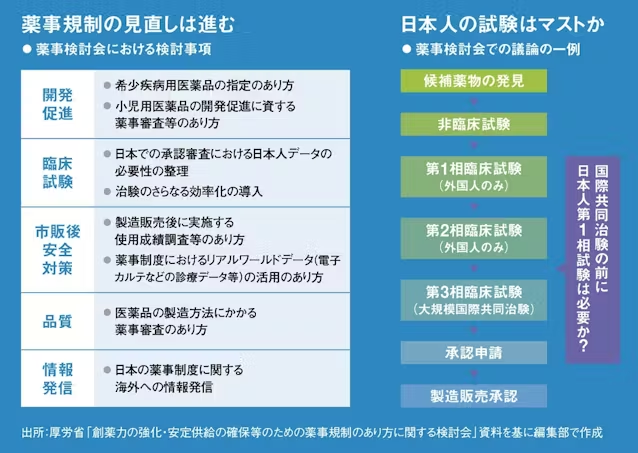
医薬品開発の最終段階である第3相臨床試験は通常、大規模な国際共同治験として実施される。この国際共同治験に日本も参加していれば、日米欧ほぼ同じタイミングで承認を取得して発売できるが、参加しなければドラッグラグ・ドラッグロスの原因となる。
従来の通知では、国際共同治験に参加する前に日本人での安全性を確認するための第1相臨床試験の実施が原則として必要とされてきた。ところが第1相、第2相臨床試験は海外の新興企業が行った後、大手製薬企業が権利を引き継いで国際共同治験を行うようなケースが増えている。その際、国際共同治験の前に日本人での第1相臨床試験が必要とされると、国際共同治験の開始が遅れるし、場合によっては日本を外して国際共同治験を実施する判断もあり得る。
検討会ではこの規制の見直しが議論され、23年12月に出された通知には、「原則として、日本人での第1相試験を追加実施する必要はない」旨が盛り込まれた。柏谷氏は、「日本人の安全性を守る必要はあるが、海外のデータを基に安全性を担保できるなら、日本人のデータをあえて取らなくていいと決まった。その分だけ患者に薬を早く届けられるという点で、大きな一歩だと思う」と語る。
このように規制の見直しが進められてはいるが、問題はこれで本当にドラッグラグ・ドラッグロスが解消するのかだ。
24年2月に名古屋市で開催された日本臨床腫瘍学会学術集会では、ドラッグロスに関するシンポジウムが開催された。シンポジウムで国立がん研究センター中央病院先端医療科の医師である山本昇副院長はこんな経験を紹介した。
・18年ごろ抗がん剤のドラッグロスが広がりつつあることに気が付き、背景に新興企業による抗がん剤の開発が増えていることがあると知った。・学会などで米国に行く機会に新興企業を訪問しようと考え、抗がん剤を開発している企業を500社以上リストアップ。その中から日本に導入すべき薬を開発している企業を選んで連絡を取り、22年以降で約30社と、学会会場での面会または本社の訪問を行った。
・会社によって対応には濃淡があったが、日本で開発するよう求めた結果、5品目の開発が決まり、うち1品目については国内での治験が始まっている。
こう説明した上で山本氏は、「ドラッグラグは待っていれば薬が日本に入ってくるが、ドラッグロスは待っていても薬が入ってこない。そもそも新興企業は日本のことなど気にしていない。日本を開発対象国に含めてもらうにはどうすればいいのかを考える必要がある」と語った。要するに、医薬品の開発主体が大手製薬企業だった時代には、黙っていても日本市場から収益を上げようと薬が入ってきた。だが、開発主体が新興企業にシフトする中で、医師自らが日本での開発誘致に乗り出さなければならなくなるほどドラッグロスは深刻化しているのだ。
実際、抗がん剤に限らず医薬品の開発において新興企業の存在感は増す一方だ。下に示したのは第1相、第2相、第3相の段階ごとの世界の臨床試験実施件数を、実施企業の規模別に色分けして示したものだ。第1相、第2相では3分の2程度が、かつては大手製薬企業が中心だった第3相臨床試験も半分近くが新興企業によって行われていることが分かる。
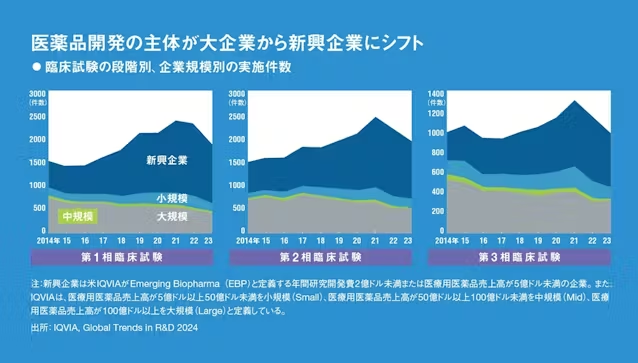
以前は多額の資金を要する第3相臨床試験の前に大手製薬企業と契約して開発権を渡すケースが多かったが、より後期の開発まで自分たちで行った方が企業の価値が高まるため、新興企業が開発の主役になりつつあるわけだ。
そんな新興企業の関心事は、最大の米国市場でいかに迅速に開発し新薬を発売するかだ。手間とコストをかけてよく知らない日本市場で発売することなど興味もないし、余裕もないということだろう。
それでも新興企業の目を日本に向けてもらおうと、医薬品の審査当局である医薬品医療機器総合機構(PMDA)は米国に事務所を開き、英語による日本の薬事制度などの紹介や、日本での新薬の開発を誘致する取り組みをスタートさせる。まずは日本のことを知ってもらうところから着手しなければ、日本に薬は届かないのだ。
割を食うのは日本国民だ
これまで新薬のドラッグロスの話題を取り上げたが、日本市場が失っているのは新薬だけではない。抗体医薬をはじめとするバイオ医薬品の特許切れ後に発売されるバイオ後続品(バイオシミラー)も、海外に比べて日本への導入が遅れている。医療的には先発品であるバイオ医薬品を使用できれば問題ないかもしれないが、安価なバイオシミラーを使用できなければその分、医療費が高止まりする要因になる。日本国民が世界標準の医療を、手ごろな費用負担で受けられるようにするには、世界標準の医薬品を日本でも使えるようにする関係者の努力が必要だ。
ドラッグロス拡大の割を食うのは日本国民だ。ただし、日本での新薬開発を促すためには臨床試験に参加する被験者の存在も不可欠だ。日本国民がこの問題を真摯に捉え、臨床試験への参加も含めて「自分事」としなければ解決は難しい。
(日経ビジネス/日経バイオテク 橋本宗明)
[日経ビジネス電子版 2024年3月27日の記事を再構成]

|
日経ビジネス電子版
週刊経済誌「日経ビジネス」と「日経ビジネス電子版」の記事をスマートフォン、タブレット、パソコンでお読みいただけます。日経読者なら割引料金でご利用いただけます。 詳細・お申し込みはこちらhttps://info.nikkei.com/nb/subscription-nk/ |
鄭重声明:本文の著作権は原作者に帰属します。記事の転載は情報の伝達のみを目的としており、投資の助言を構成するものではありません。もし侵害行為があれば、すぐにご連絡ください。修正または削除いたします。ありがとうございます。

